સંપર્ક સંભવિતમાં તફાવત
જો બે અલગ-અલગ ધાતુઓના બનેલા બે નમૂનાઓને એકસાથે ચુસ્ત રીતે દબાવવામાં આવે, તો તેમની વચ્ચે સંપર્ક સંભવિત તફાવત આવશે. ઇટાલિયન ભૌતિકશાસ્ત્રી, રસાયણશાસ્ત્રી અને ફિઝિયોલોજિસ્ટ એલેસાન્ડ્રો વોલ્ટાએ 1797 માં ધાતુઓના વિદ્યુત ગુણધર્મોનો અભ્યાસ કરતી વખતે આ ઘટના શોધી કાઢી હતી.

પછી વોલ્ટાને જાણવા મળ્યું કે જો તમે આ ક્રમમાં ધાતુઓને સાંકળમાં જોડો છો: Al, Zn, Sn, Pb, Bi, Hg, Fe, Cu, Ag, Au, Pt, Pd, તો પરિણામી સાંકળમાં દરેક અનુગામી ધાતુ પ્રાપ્ત કરશે. ની સંભવિતતા - પાછલા એક કરતા ઓછી. તદુપરાંત, વૈજ્ઞાનિકે શોધી કાઢ્યું કે આ રીતે સંયોજિત ઘણી ધાતુઓ આ સર્કિટમાં આ ધાતુઓની ગોઠવણીના ક્રમને ધ્યાનમાં લીધા વિના રચાયેલા સર્કિટના છેડા વચ્ચે સમાન સંભવિત તફાવત આપશે - આ સ્થિતિ હવે વોલ્ટાના શ્રેણીના સંપર્કોના નિયમ તરીકે ઓળખાય છે. .
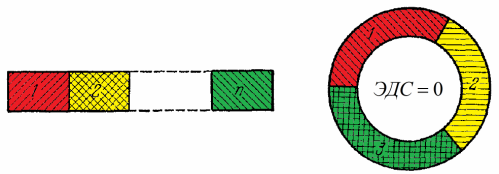
અહીં તે સમજવું અત્યંત અગત્યનું છે કે સંપર્ક ક્રમના કાયદાના ચોક્કસ અમલીકરણ માટે, સમગ્ર મેટલ સર્કિટ સમાન તાપમાને હોવું જરૂરી છે.
જો આ સર્કિટ હવે પોતાના છેડાથી બંધ છે, તો તે કાયદાનું પાલન કરે છે કે સર્કિટમાં EMF શૂન્ય હશે.પરંતુ જો આ તમામ (ધાતુ 1, ધાતુ 2, ધાતુ 3) સમાન તાપમાને હોય તો જ, અન્યથા કુદરતનો મૂળભૂત નિયમ-ઊર્જા સંરક્ષણનો કાયદો-ભંગ થશે.
ધાતુઓની વિવિધ જોડી માટે, સંપર્ક સંભવિત તફાવત તેના પોતાના હશે, જે વોલ્ટના દસમા અને સોમા ભાગથી લઈને થોડા વોલ્ટ સુધીનો હશે.
સંપર્ક સંભવિત તફાવતના દેખાવનું કારણ સમજવા માટે, મફત ઇલેક્ટ્રોન મોડેલનો ઉપયોગ કરવો અનુકૂળ છે.
જોડીની બંને ધાતુઓને સંપૂર્ણ શૂન્ય તાપમાન પર રહેવા દો, પછી ફર્મી મર્યાદા સહિત તમામ ઉર્જા સ્તરો ઇલેક્ટ્રોનથી ભરાઈ જશે. ફર્મી ઊર્જાનું મૂલ્ય (મર્યાદા) ધાતુમાં વહન ઇલેક્ટ્રોનની સાંદ્રતા સાથે નીચે મુજબ છે:
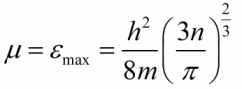
m એ ઇલેક્ટ્રોનનું બાકીનું દળ છે, h એ પ્લાન્કનું સ્થિરાંક છે, n એ વહન ઇલેક્ટ્રોનની સાંદ્રતા છે
આ ગુણોત્તરને ધ્યાનમાં લેતા, અમે અલગ-અલગ ફર્મી ઉર્જા સાથે અને તેથી વહન ઇલેક્ટ્રોનની વિવિધ સાંદ્રતા સાથે બે ધાતુઓના નજીકના સંપર્કમાં લાવીએ છીએ.
ચાલો આપણે આપણા ઉદાહરણ માટે માની લઈએ કે બીજી ધાતુમાં વહન ઈલેક્ટ્રોનની ઊંચી સાંદ્રતા છે અને તે મુજબ બીજી ધાતુનું ફર્મી સ્તર પ્રથમ કરતા વધારે છે.
પછી, જ્યારે ધાતુઓ એકબીજાના સંપર્કમાં આવે છે, ત્યારે ધાતુ 2 થી મેટલ 1 સુધી ઇલેક્ટ્રોનનું પ્રસરણ (એક ધાતુમાંથી બીજી ધાતુમાં પ્રવેશ) શરૂ થશે, કારણ કે ધાતુ 2 એ ઉર્જા સ્તરો ભરે છે જે પ્રથમ ધાતુના ફર્મી સ્તરથી ઉપર છે. , જેનો અર્થ છે કે આ સ્તરોમાંથી ઇલેક્ટ્રોન મેટલ 1 ખાલી જગ્યાઓ ભરશે.
આવી પરિસ્થિતિમાં ઈલેક્ટ્રોનની વિપરીત હિલચાલ ઊર્જાસભર રીતે અશક્ય છે, કારણ કે બીજી ધાતુમાં તમામ નીચલા ઉર્જા સ્તરો પહેલેથી જ સંપૂર્ણપણે ભરાઈ ગયા છે.આખરે, ધાતુ 2 સકારાત્મક રીતે ચાર્જ થશે અને 1 ધાતુ નકારાત્મક રીતે ચાર્જ થશે, જ્યારે પ્રથમ ધાતુનું ફર્મી સ્તર તેના કરતા વધારે થશે અને બીજી ધાતુનું ફર્મી સ્તર ઘટશે. આ ફેરફાર નીચે મુજબ હશે.
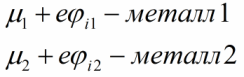
પરિણામે, સંપર્ક કરતી ધાતુઓ અને અનુરૂપ વિદ્યુત ક્ષેત્ર વચ્ચે સંભવિત તફાવત ઊભો થશે, જે હવે ઇલેક્ટ્રોનના વધુ પ્રસારને અટકાવશે.
જ્યારે સંભવિત તફાવત બે ધાતુઓના ફર્મી સ્તરોની સમાનતાને અનુરૂપ ચોક્કસ મૂલ્ય સુધી પહોંચે ત્યારે તેની પ્રક્રિયા સંપૂર્ણપણે બંધ થઈ જશે, જેમાં ધાતુ 2માંથી નવા આવેલા ઈલેક્ટ્રોન માટે મેટલ 1 અને મેટલ 2માં કોઈ મુક્ત સ્તર રહેશે નહીં. મેટલ 1 માંથી ઇલેક્ટ્રોન સ્થળાંતરની શક્યતા પર કોઈ સ્તર મુક્ત કરવામાં આવશે નહીં. ઊર્જા સંતુલન આવશે:

ઇલેક્ટ્રોનનો ચાર્જ નકારાત્મક હોવાથી, આપણી પાસે સંભવિતતાઓની તુલનામાં નીચેની સ્થિતિ હશે:

જો કે આપણે મૂળ રીતે ધાતુઓનું તાપમાન નિરપેક્ષ શૂન્ય હોવાનું માની લીધું છે, તેમ છતાં સમાન રીતે કોઈપણ તાપમાને સંતુલન થશે.
વિદ્યુત ક્ષેત્રની હાજરીમાં ફર્મી ઉર્જા એ એક ઇલેક્ટ્રોન ગેસમાં એક ઇલેક્ટ્રોનની રાસાયણિક સંભવિતતા સિવાય બીજું કશું જ નહીં હોય, જે તે સિંગલ ઇલેક્ટ્રોનના ચાર્જનો ઉલ્લેખ કરે છે, અને સંતુલન સ્થિતિમાં બંને ધાતુઓના ઇલેક્ટ્રોન વાયુઓની રાસાયણિક સંભવિતતા સમાન હશે, તે માત્ર તાપમાન પર રાસાયણિક સંભવિતતાની અવલંબનને ધ્યાનમાં લેવા માટે ઉમેરવા માટે જરૂરી છે.
તેથી, અમારા દ્વારા ગણવામાં આવતા સંભવિત તફાવતને આંતરિક સંપર્ક સંભવિત તફાવત કહેવામાં આવે છે અને શ્રેણીના સંપર્કો માટે વોલ્ટાના કાયદાને અનુરૂપ છે.
ચાલો આ સંભવિત તફાવતનો અંદાજ લગાવીએ, આ માટે આપણે ફર્મી ઊર્જાને વહન ઇલેક્ટ્રોનની સાંદ્રતાના સંદર્ભમાં વ્યક્ત કરીએ છીએ, પછી સ્થિરાંકોના સંખ્યાત્મક મૂલ્યોને બદલીએ છીએ:
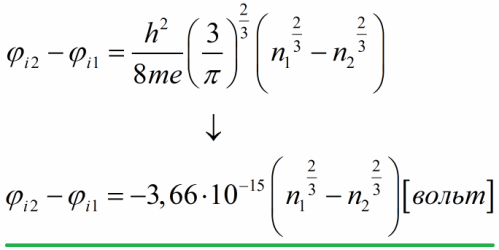
આમ, ફ્રી ઇલેક્ટ્રોન મોડલના આધારે, ધાતુઓ માટે આંતરિક સંપર્ક સંભવિત તફાવત એક વોલ્ટના સોમા ભાગથી કેટલાક વોલ્ટ સુધીના તીવ્રતાના ક્રમ પર છે.
